En algunos niños, se ha demostrado que las infusiones semanales de EXONDYS 51 (eteplirsen) ayudan al cuerpo a producir una forma más corta de la proteína distrofina.

Información sobre EXONDYS 51.
EXONDYS 51 es un tratamiento para la distrofia muscular de Duchenne. Utiliza una tecnología llamada “omisión de exón”, que ayuda al cuerpo a producir una forma más corta de la proteína distrofina. EXONDYS 51 consiste en una infusión semanal.
EXONDYS 51 se utiliza para tratar a pacientes con distrofia muscular de Duchenne (DMD) que tienen una mutación confirmada en el gen de la distrofina, que puede ser tratada mediante la omisión del exón 51. EXONDYS 51 fue aprobado bajo aprobación urgente. La aprobación urgente permite que los fármacos se aprueben en función de un marcador que se considera con probabilidad razonable de predecir un beneficio clínico. El tratamiento con EXONDYS 51 aumentó el marcador, distrofina, en el músculo esquelético en algunos pacientes. La verificación del beneficio clínico puede ser necesaria para que EXONDYS 51 continúe siendo aprobado.
Resultados de los estudios clínicos de EXONDYS 51.
Los investigadores realizaron ensayos clínicos de EXONDYS 51 para analizar diferentes aspectos del medicamento, incluido si desencadena la omisión del exón 51 en el gen de la distrofina. También analizaron la cantidad de distrofina producida, junto con su perfil de seguridad. Se llevó a cabo un estudio con EXONDYS 51 en niños varones que tenían una mutación confirmada en el gen de la distrofina que podía tratarse mediante la omisión del exón 51. Comprenda lo que esto significa.
Diseñado para omitir el exón 51.
Mediante tres estudios clínicos, se analizó si se produjo la omisión de exón en el gen de la distrofina de los niños varones tratados con EXONDYS 51. En estudios clínicos, se produjo una omisión de exón en los 36 participantes evaluados.


Los niveles de distrofina aumentaron en algunos participantes del ensayo clínico.
Un estudio en 12 niños con distrofia muscular de Duchenne comparó el nivel de distrofina en el cuerpo antes de la primera infusión de EXONDYS 51 con el nivel de distrofina después de 48 semanas de tratamiento con el mismo. Las infusiones semanales de EXONDYS 51 ayudaron al cuerpo a producir una forma más corta de la proteína distrofina.
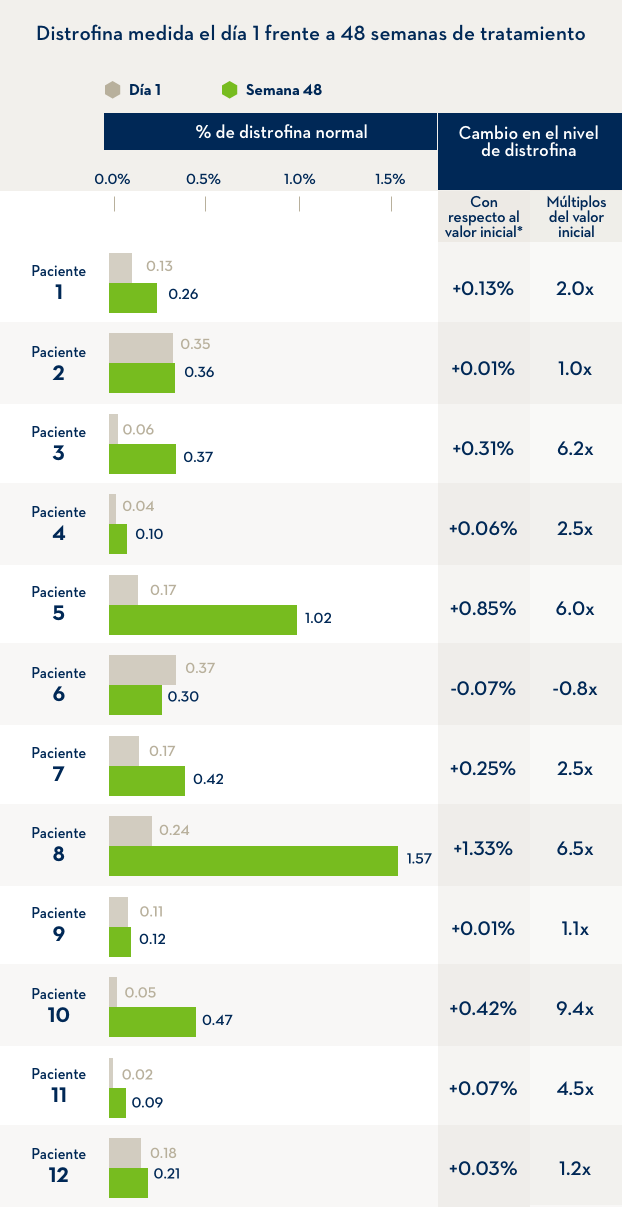
*Después de 48 semanas, los niveles de distrofina fueron, en promedio, 2.8 veces más altos que aquellos observados antes del inicio del tratamiento, pero permanecieron en un nivel mucho más bajo que el producido por las personas sin Duchenne. En otro estudio en niños varones tratados durante 180 semanas, los niveles de distrofina alcanzaron un promedio del 0.93 % en comparación con el nivel presente en personas sin Duchenne El cambio en los niveles de distrofina es el % de distrofina normal en la semana 48 menos el % de distrofina normal al inicio del estudio (inicio).

¿Qué sabemos a partir de los resultados?
El nivel inicial de distrofina fue del
0.16 %
en comparación con el nivel normal
Después de 48 semanas, el nivel promedio de distrofina fue del
0.44 %
en comparación con el nivel normal
pero los niveles aún se mantuvieron mucho más bajos que los niveles de las personas sin Duchenne
Los participantes mostraron un aumento promedio de la distrofina
2.8 veces mayor al
del nivel inicial,
pero los niveles aún se mantuvieron mucho más bajos que los niveles de las personas sin Duchenne

¿Cuáles son los riesgos? Los investigadores evaluaron los riesgos y la tolerabilidad de EXONDYS 51. Al igual que con cualquier medicamento, debe analizar con su médico los riesgos y los efectos secundarios relacionados con EXONDYS 51.
Resultados adicionales del estudio.
En un estudio separado en 12 pacientes, el nivel promedio de distrofina después de 180 semanas** fue del
0.93 %
en comparación con el nivel normal
pero los niveles aún se mantuvieron mucho más bajos que los niveles de las personas sin Duchenne
**No se dispuso de los niveles iniciales de todos los participantes.

